Texto: Amanda Gonzalez (facebook: amanda.gonzalez.5264)
Revisores: Ananias Q. Oliveira Filho (@ananias_1979); Mellanie F. Dutra (@mellziland)
Recentemente, a Agência Nacional de Vigilância Sanitária (Anvisa) autorizou a participação de voluntários brasileiros nos testes clínicos da vacina ChAdOx1 nCoV-19, desenvolvida contra o novo coronavírus pelo Instituto Jenner da Universidade de Oxford, Reino Unido. A decisão foi publicada no dia 02 de junho em Edição Extra do Diário Oficial da União (D.O.U.), após requisição dos representantes brasileiros da indústria farmacêutica sueco-britânica AstraZeneca, apoiadora do projeto, e avaliação do pedido pelo comitê da Gerência Geral de Medicamentos (GGMED) da Anvisa. Esse comitê, criado especialmente para atender as urgências da pandemia, objetiva dar celeridade aos processos de regulação de tratamentos contra o novo coronavírus no território nacional [1, 2, 3].
A denominação da vacina refere-se à tecnologia utilizada para sua criação, assim como sua procedência e alvo: Chimpanzee Adenovirus Oxford 1 new CoronaVirus-19, ou, de outra forma, “adenovírus de chimpanzé 1 desenvolvido em Oxford para prevenir o novo coronavírus (SARS-CoV-2)”. Ela contém um vírus (adenovírus de macaco) modificado em laboratório para conter o material genético da proteína S (ou spike) do coronavírus. As modificações também impedem que o adenovírus se replique e cause dano nas nossas células, mas permitem que ele leve o RNA da spike para dentro das células. Uma vez no interior celular, o objetivo é que a proteína S seja produzida e apresentada ao sistema imunológico, gerando anticorpos protetores contra o SARS-CoV-2 (veja a figura abaixo).
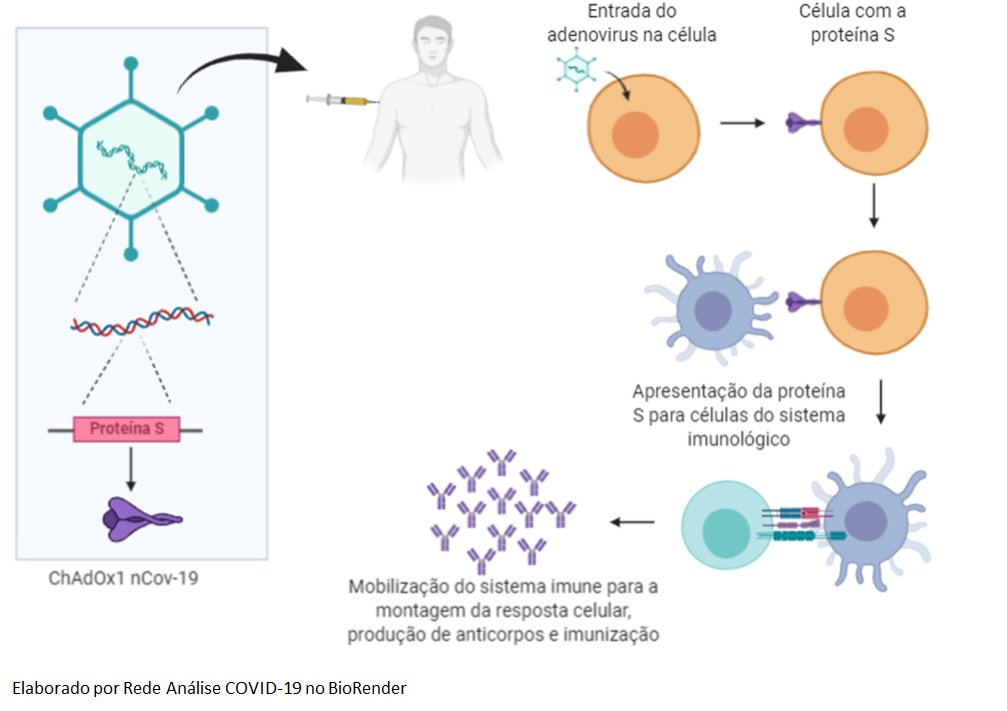
Apesar de ainda não haver vacina licenciada que utiliza o ChAdOx1, outras vacinas com essa tecnologia vem sendo testadas com segurança em seres humanos desde 2012, em formulações contra malária, gripe (influenza), tuberculose, câncer de próstata, febre chikungunya e síndrome respiratória aguda do oriente médio (MERS) [4]. Estes testes anteriores, sobretudo aqueles referentes à MERS, também causada por um tipo de coronavírus, permitiram o desenrolar rápido da fase pré-clínica da vacina contra o SARS-CoV-2 [5]. A fase pré-clínica é aquela que antecede os testes em seres humanos e que busca avaliar todas as características da vacina, incluindo sua capacidade de imunizar com segurança modelos animais. Os testes pré-clínicos são pré-requisito para o início das fases clínicas, porém a extensão dos estudos varia caso-a-caso, podendo em parte serem realizados de forma concomitante aos testes em pessoas [6]. Dessa forma, após desenvolverem a formulação, os pesquisadores de Oxford inocularam macacos com a ChAdOx1 nCoV-19 em parceria com o Instituto de Alergias e Doenças Infecciosas dos Estados Unidos. Os resultados preliminares foram disponibilizados em meados de maio na plataforma bioRxiv na forma de artigo científico não revisado por pares. O documento descreve que a vacina se mostrou segura e protetiva nos animais, impedindo a ocorrência de pneumonia quando expostos ao novo coronavírus. Porém, a imunização não impediu que o vírus infectasse e replicasse no sistema respiratório dos macacos, fato que causa preocupação, sobretudo em relação à possibilidade de indivíduos vacinados ainda poderem transmitir a COVID-19 [7]. Estudos adicionais em animais estão sendo realizados atualmente [5].
As etapas de testagem de qualquer tratamento em humanos são chamadas fases clínicas, e ocorrem após os estudos pré-clínicos. Tradicionalmente, devem ser executadas 3 fases de testes clínicos antes do processo de licenciamento de uma nova vacina: fase I, fase II e fase III. Segundo guia da Organização Mundial da Saúde (OMS), de modo geral, a fase I se preocupa em avaliar a melhor dose vacinal, levando em conta os efeitos adversos e a ativação imune específica dos voluntários. A fase II avalia os mesmos quesitos da fase I, porém em um maior número de pessoas e incluindo menores de 18 anos e maiores de 55. Isso ocorre desta maneira por pelo menos três motivos: 1) por existirem questões éticas quanto ao envolvimento de menores de idade em testes clínicos (a decisão cabe aos responsáveis legais); 2) por questão de proteção da saúde de pessoas mais idosas e crianças; 3) por existirem particularidades naturais no funcionamento do sistema imune de idosos e crianças. Assim, mesmo que a vacina desenvolvida tenha como foco proteger a população acima de 55 anos ou crianças pequenas, é preciso ter mais cautela com essas populações, incluindo-as posteriormente nos estudos clínicos. Já a fase III inclui grande número de voluntários (na casa dos milhares) e busca concluir se o produto realmente é eficaz na prevenção de determinada doença. Basicamente, busca analisar, algum tempo após a imunização, se os indivíduos vacinados que tiveram a possibilidade de se exporem naturalmente ao patógeno se infectaram ou não. Esse tipo de análise pode demorar anos, pois depende da circulação do patógeno na população: se o risco das pessoas se infectarem for muito baixo, é impossível saber se não ficaram doentes por conta da vacina ou por não terem tido contato com o agente patogênico. Importante lembrar que seres humanos, mesmo quando voluntários, não devem ser infectados experimentalmente com patógenos como o SARS-CoV-2 [8].
É possível também que uma potencial vacina seja testada em fases combinadas, ou seja, avaliando aspectos de fases diferentes em um mesmo estudo. Essa abordagem foi adotada pelos pesquisadores de Oxford que, em 23 de abril de 2020, iniciaram teste de fases I e II em voluntários saudáveis. O ensaio contou com 1090 participantes do Reino Unido, todos adultos com 18 até 55 anos. Eles foram separados em grupos experimentais e controle, de forma que alguns receberam a vacina ChAdOx1 nCoV-19 e outros receberam uma vacina controle já licenciada, a MenACWY, contra meningite. Para uma avaliação com menos vieses, não foi dito aos participantes qual dos tratamentos estava sendo dado a eles. A vacina foi aplicada em dose única, 5 x 10^10 partículas virais, estabelecida a partir de outros estudos clínicos utilizando o ChAdOx1, de forma a acelerar o processo. Os objetivos dessa fase I/II foram avaliar os efeitos adversos e a ativação do sistema imune dos voluntários. Adicionalmente, outros dois aspectos foram estudados: se uma dose de reforço após 4 semanas seria adequada e se o uso do medicamento paracetamol serviria para prevenir efeitos adversos sem influenciar na ativação da imunidade [9].
Apesar dos resultados preliminares desses ensaios ainda não terem sido divulgados (estão em fase final de análise) , já foi aprovada uma fase II/III para a ChAdOx1 nCoV-19, que vai avaliar, além da segurança e da imunogenicidade, a eficácia preliminar da vacina. Dos 10260 voluntários previstos, 2000 serão brasileiros.
E qual o motivo pelo qual nosso país foi escolhido? Pelo menos um deles remete a nossa curva epidêmica de COVID-19. O Reino Unido, com aplicação de medidas de isolamento, conseguiu controlar o aumento de casos de COVID-19 e hoje apresenta uma curva descendente, ou seja, cada dia há menos casos confirmados. Já o Brasil apresenta uma curva em franca ascendência, reflexo do descontrole diante da pandemia. Tal situação, contudo, é muito interessante para o estudo da eficácia da nova vacina, pois nossa população está vivendo em grande risco de contaminação.
Pelo menos 1000 dos voluntários participantes serão profissionais da linha de frente contra o coronavírus recrutados pela Universidade Federal de São Paulo (Unifesp). A realização dos testes em São Paulo contará com o apoio da Fundação Lemann [10]. Outros 1000 voluntários serão recrutados no Rio de Janeiro pela Rede D’Or São Luiz e Instituto D’Or (IDOR) [11]. Até o momento, não foi disponibilizado contato para inscrição de participantes.
[4] https://www.vaccitech.co.uk/technology/
[5] http://www.ox.ac.uk/news/2020-05-22-oxford-covid-19-vaccine-begin-phase-iiiii-human-trials
[7] https://www.biorxiv.org/content/10.1101/2020.05.13.093195v1.full.pdf
[8] https://www.who.int/biologicals/expert_committee/WHO_TRS_1004_web_Annex_9.pdf?ua=1
[9] https://clinicaltrials.gov/ct2/show/NCT04324606?term=ChAdOx1&draw=3&rank=13
[11] https://saude.abril.com.br/medicina/a-jornada-pela-primeira-vacina-contra-o-coronavirus-no-brasil/



